Lors de la purification de peptides, il est très courant de devoir utiliser du TFA comme additif. L’utilisation d’un spectromètre de masse comme mode de détection est aussi répandu, afin de confirmer les masses des produits à purifier. Que se passe-t-il si on souhaite utiliser ces deux conditions ?
Le TFA se lie fortement aux analytes à purifier, et il en résulte alors une réduction du signal MS dans les meilleurs des cas, pouvant aller jusqu’à la suppression total du signal, à cause de l’équilibre suivant :

La forme “globalement” neutre, prédominante, n’est pas détectée en masse.
On peut alors se dire que ces deux paramètres sont incompatibles, et qu’il faut donc changer les conditions de purification, par exemple en remplaçant le TFA par de l’acide formique.
Nous allons démontrer dans cet article qu’une astuce permet quand même d’obtenir un signal, sans avoir à redévelopper la méthode, et donc, gagner du temps sur cette étape.
Solution à envisager
Est-il possible de modifier l’équilibre précédemment décrit pour alors l’inverser, afin de permettre la détection en spectrométrie de masse ?
L’ajout d’un autre acide faible, tel qu’un acide carboxylique est une solution envisageable.
Les deux acides (TFA et acide carboxylique) sont donc en compétition, et cet équilibre est le suivant :

Le TFA garde sa forme acide, et ne peut donc plus intervenir dans le processus de détection.
Dans ces conditions, le premier équilibre, donné en introduction, est alors déplacé en faveur de la forme (M+H)+ + CF3C00–, car l’acide carboxylique permet de réduire la présence de TFA sous forme CF3C00–, la détection est alors possible !
Application
Pour montrer l’efficacité de cette théorie, l’application suivante a été mise en œuvre.
Protocole :
Solvants :
Eau + 0,1 % TFA
Acétonitrile + 0,1 %TFA
Gradient : de 5 à 40 % d’acétonitrile en 45 min
Échantillons :
 |
 |
 |
Concentration : 20 mg/mL
Quantité injecté : 150 µL
Colonne : PFB-15C18N-F0025
Détection :
UV 254 nm
MS XIC 1 : 235-241 m/z
MS XIC 2 : 377-383 m/z
MS XIC 3 : 571-577 m/z
TIC 220-1200 m/z
Instrumentation :
puriFlash®5.250 + Interface MS + Détecteur MS

Schéma :
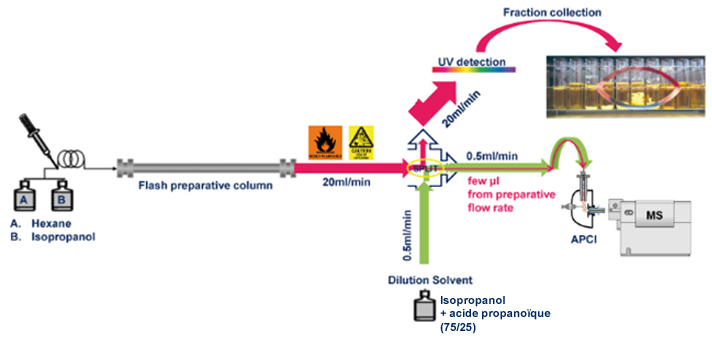
Résultats :
Chromatogramme UV
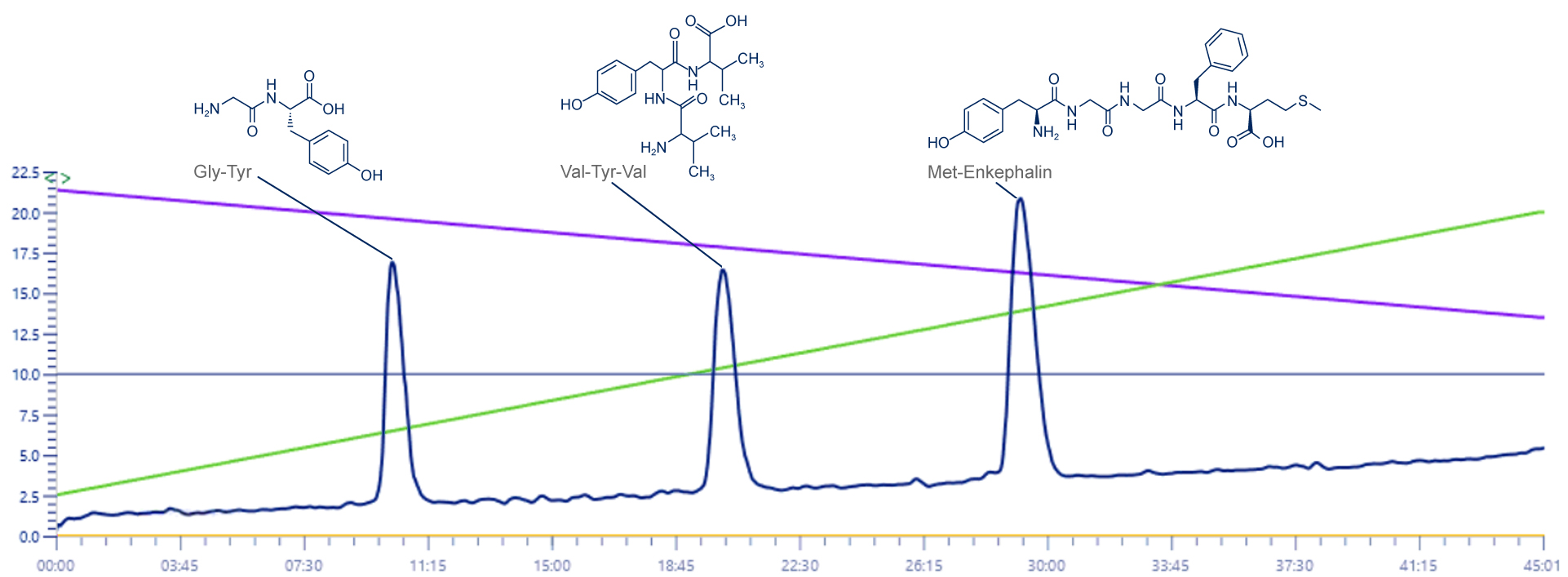 Ce signal n’est pas impacté, et est présent ici à titre indicatif.
Ce signal n’est pas impacté, et est présent ici à titre indicatif.
Signal XIC 235-241 m/z
Solvant make-up : Isopropanol
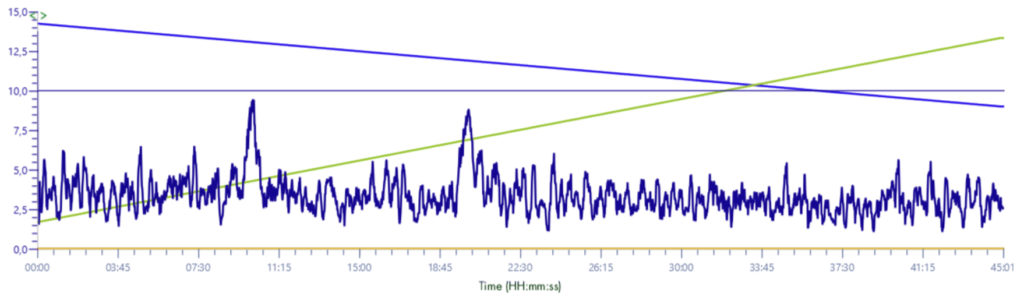
Solvant make-up : Isopropanol + 25 % acide propanoïque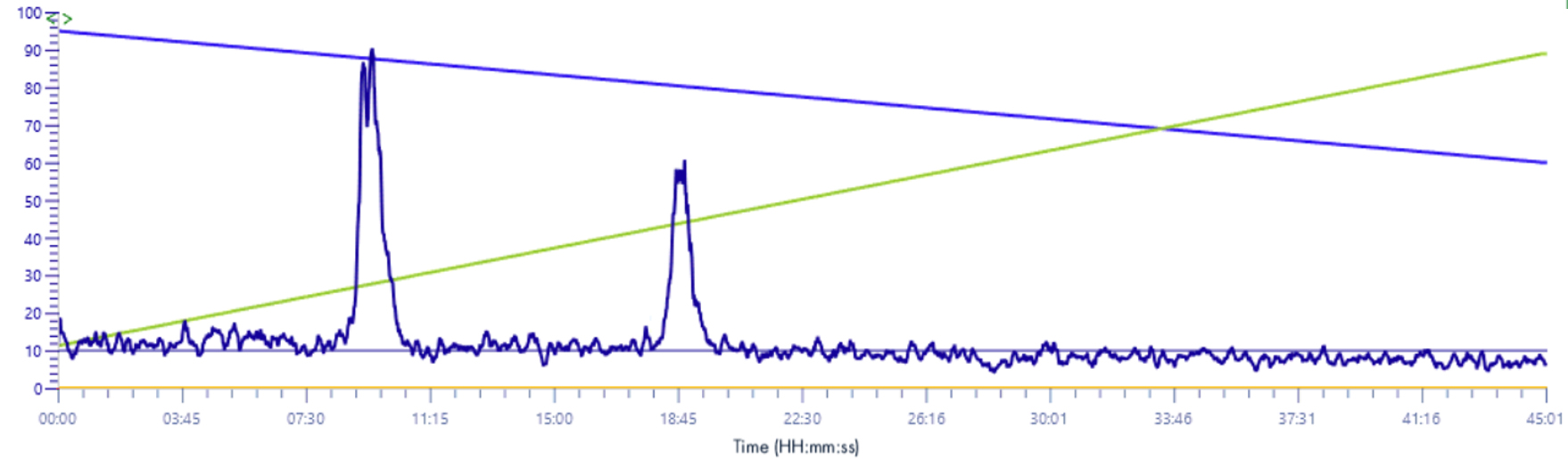
La différence entre les signaux est importante, sans cette solution le signal est presque absorbé par le bruit de fond.
Avec cette solution le signal gagne en intensité et est multiplié par 10.
Signal XIC 377-383 m/z
Solvant make-up : Isopropanol
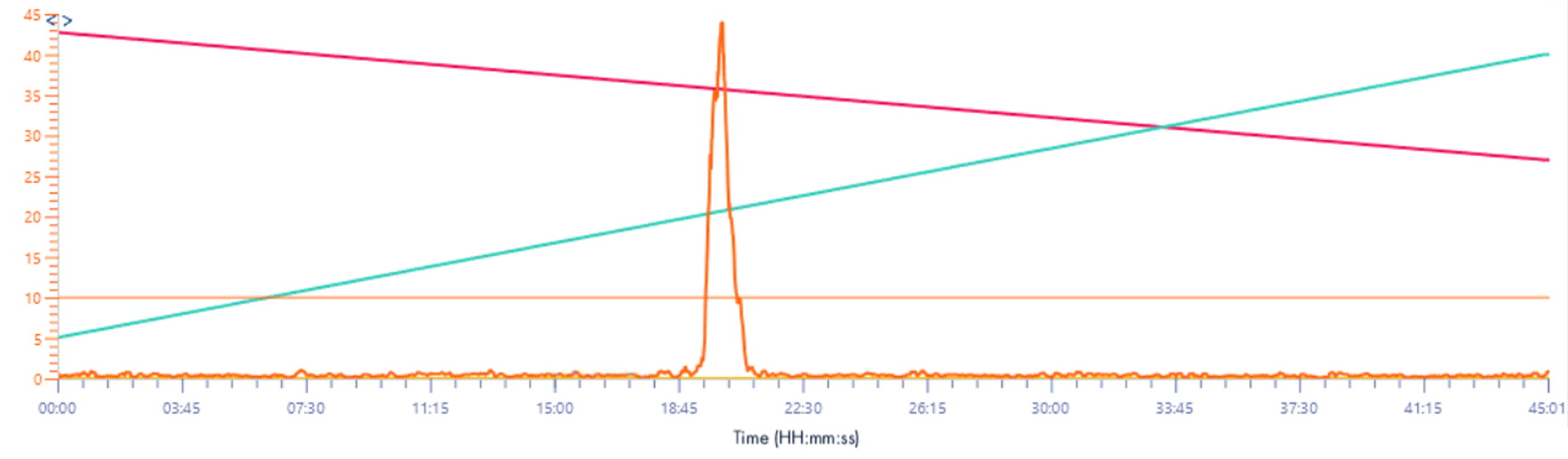
Solvant make-up : Isopropanol + 25% acide propanoïque
Ici le signal n’est pas “perdu” dans le bruit de fond, si on utilise juste de l’isopropanol comme solvant de make-up.
En utilisant de l’acide propanoïque on remarque la même chose que précédemment, l’intensité est plus élevée, de l’ordre de 10x aussi.
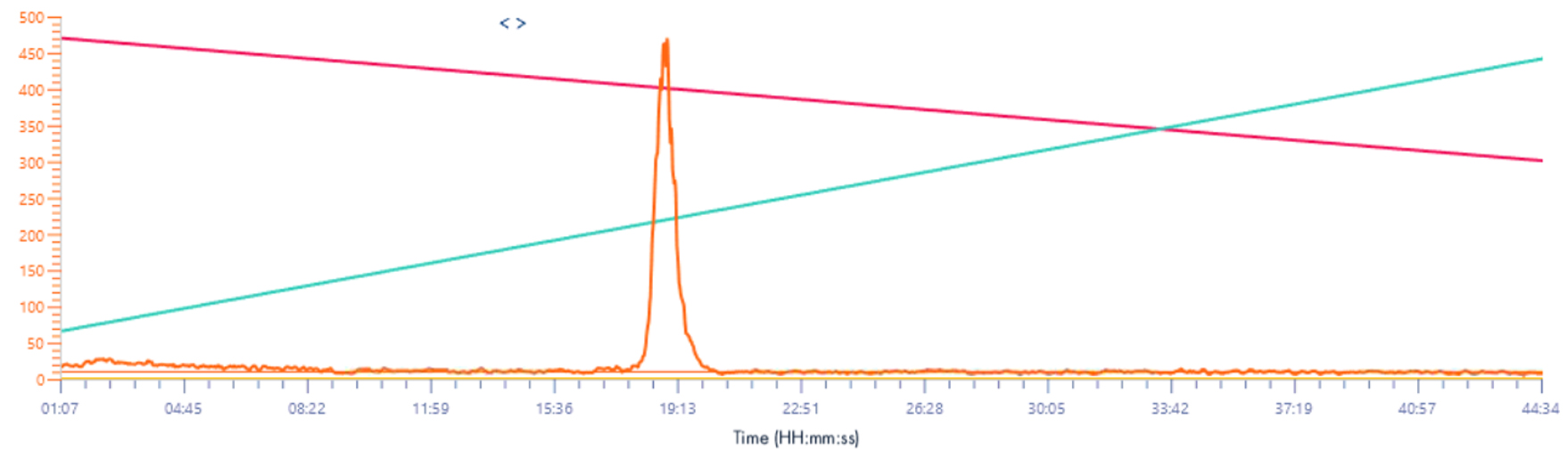
Signal XIC 571-577/z
Solvant make-up : Isopropanol
Solvant make-up : Isopropanol + 25 % acide propanoïque
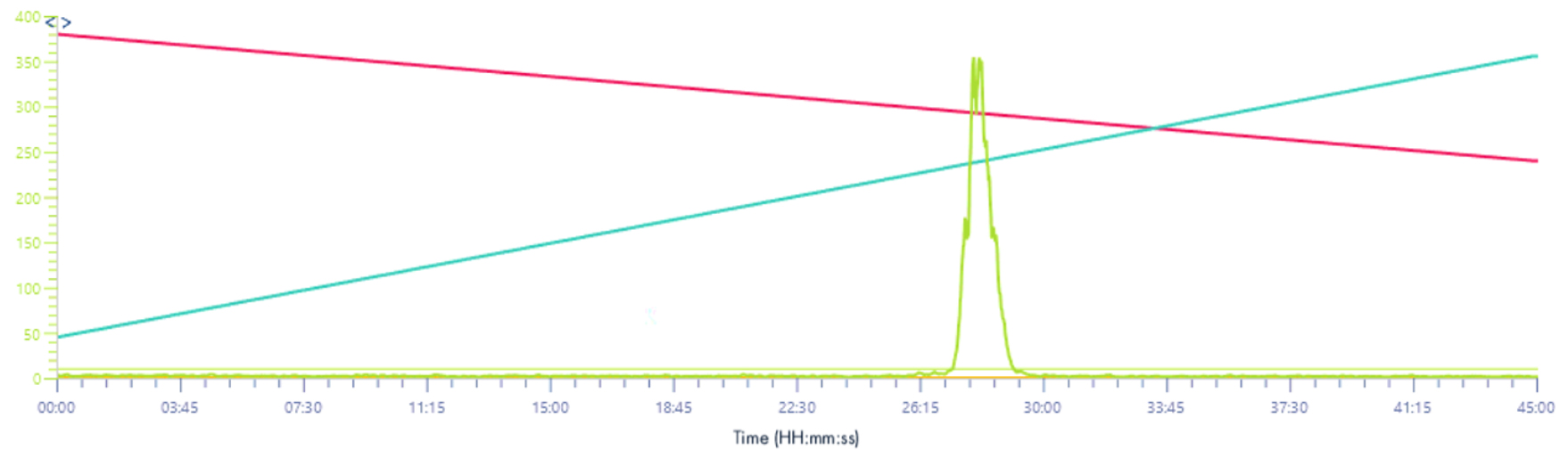
Même résultat que pour le signal XIC 2, l’intensité du signal est multipliée par 10.
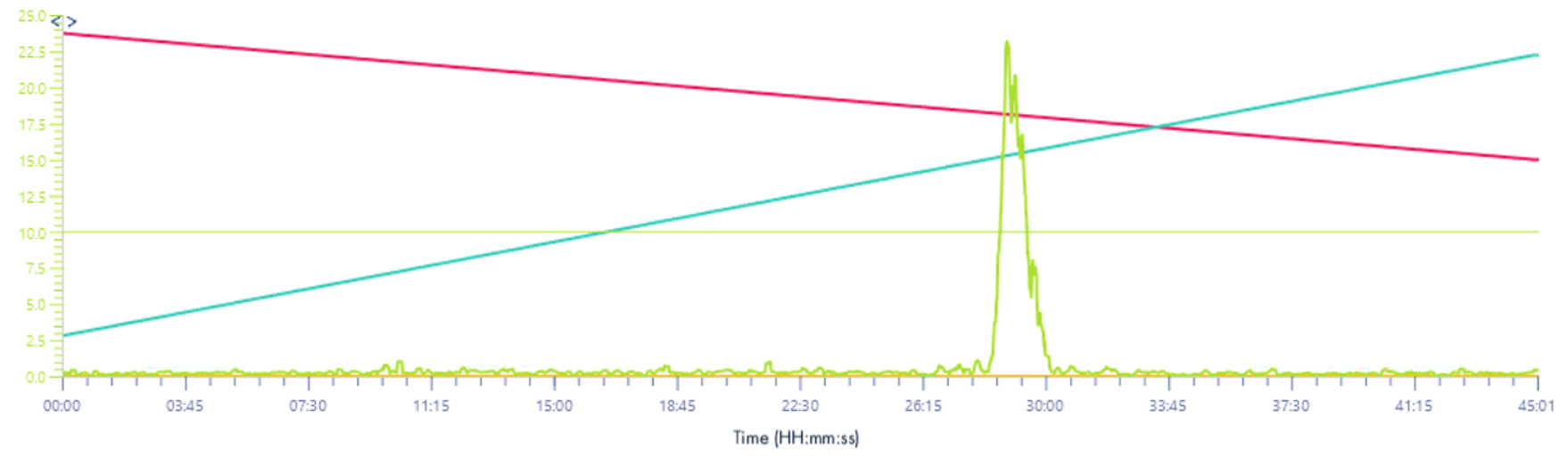
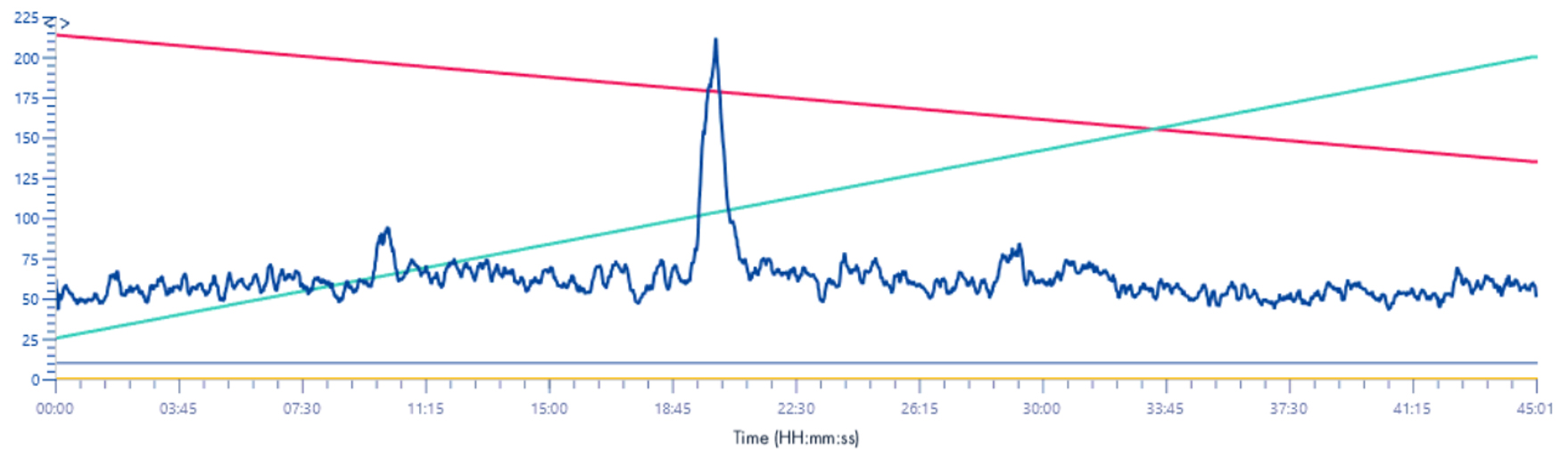
TIC 220-1200 m/z
Solvant make-up : Isopropanol
Solvant make-up : Isopropanol + 25% acide propanoïque
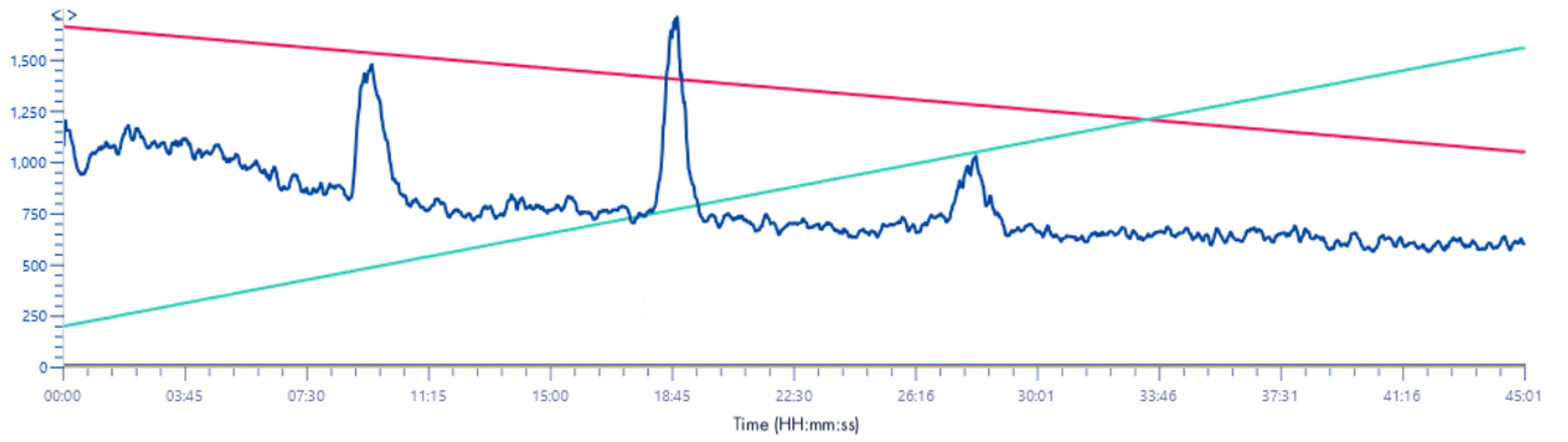
Ici aussi, on s’aperçoit que l’utilisation de l’acide propanoïque permet une visualisation beaucoup plus nette des signaux en masse.
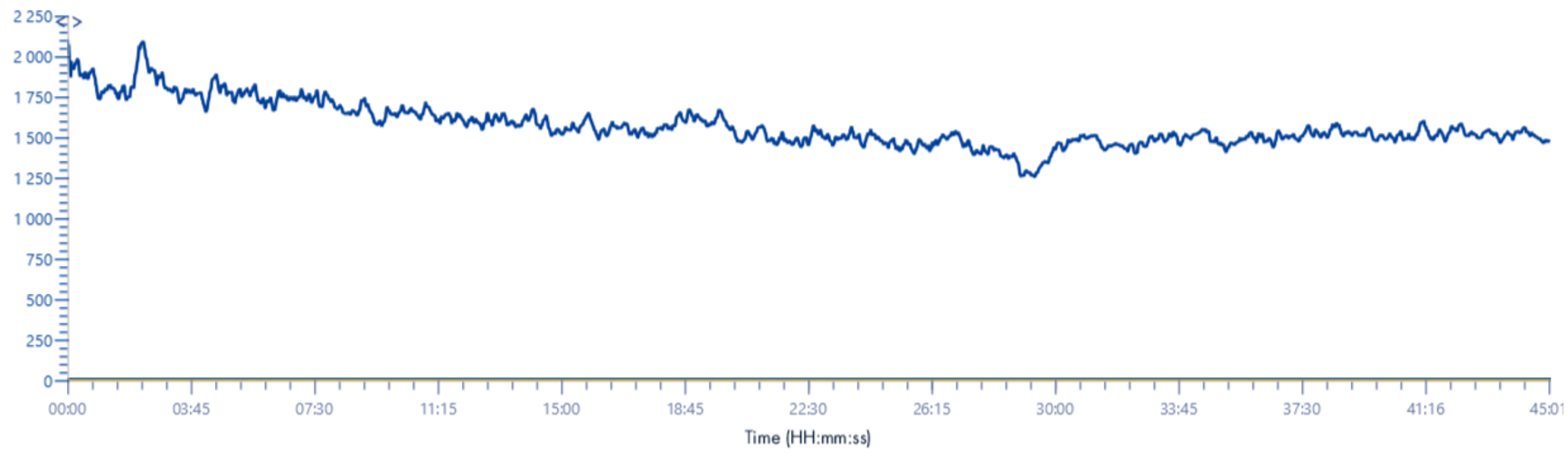
NB : Pour le signal TIC, nous avons été obligés d’augmenter la borne m/z inférieure. En effet, si cette valeur est à 100 m/z nous n’avons plus de signal, celui-ci étant totalement absorbé par les signaux émis entre 100 et ~180m/z (voir chromatogramme ci-dessous).
Conclusion
Cette astuce peut donc être utilisée afin de ne pas avoir à redévelopper de nouvelles méthodes, et permet donc un gain de temps conséquent.
Il est à noter que nous avons utilisé de l’acide propanoïque, mais que serait le résultat avec d’autres acides ?
L’acide formique, à cause de sa volatilité trop importante (plus importance que le TFA), ne permet pas la visualisation des signaux.
Les acides acétique, propanoïque et butanoïque donnent de bon résultats. L’acide butanoïque donne même les meilleurs résultats, cependant à cause de l’odeur qu’il dégage son utilisation n’est pas recommandée
Les acides carboxyliques avec des chaines carbonées plus importantes, à cause de leur manque de volatilité donnent des résultats moins bons.
En savoir plus :
- Retrouvez nos notes d’application disponibles sur www.flash-chromatographie.com/ressources/application-notes
- Découvrez les systèmes de purification de peptides Interchim® : www.flash-chromatographie.com/peptide-oligonucleotide-purification-puriflash